Nos introduciremos a un tema vital del ser humano.. " El Agua " ¿ Sabias que... ? La forma en que vivimos tiene una gran influencia en nuestro entorno debido a los patrones de consumo, es decir, al uso que le damos a los recursos, lo que consumimos y como lo hacemos. Por ello es importante saber que nuestras actividades tienen un efecto en el medio ambiente y que debemos tratar de evitar que sean dañinas.
miércoles, 23 de febrero de 2011
martes, 22 de febrero de 2011
Estructura molecular del agua: Enlaces covalentes. moléculas polares y no polares. Puentes de hidrógeno
MOLÉCULA DEL AGUA.



La dilatación del agua al solidificarse también tiene efectos de importancia en los procesos geológicos de erosión. Al introducirse agua en grietas del suelo y congelarse posteriormente, se originan tensiones que rompen las rocas.
ENLACE COVALENTE
Un enlace covalente se produce por compartición de electrones entre dos o mas átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómicoen cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrónes, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.
MOLECULAS POLARES Y NO POLARES
Las moléculas apolares son aquellas moléculas que se producen por la unión entre átomos que poseen igual electronegatividad, por lo que las fuerzas con las que los átomos que conforman la molécula atraen los electrones del enlace son iguales, produciéndose así la anulación de dichas fuerzas. Un ejemplo de una molécula apolar es la molécula de Oxígeno(O2). En esta molécula cada átomo de Oxígeno atrae a los electrones compartidos hacia sí mismo con una misma intensidad pero en sentidos opuestos, por lo que se anulan las fuerzas de atracción y la molécula no se convierte en un dipolo.
Molécula No-polar Una molécula que tiene una distribución igual de electrones enlazados. Las moléculas no-polares están formadas por enlaces covalentes no-polares o cuando enlaces covalentes polares dan como resultado una distribución simétrica de la carga eléctrica. La configuración + - - +, por ejemplo. Compare con la molécula polar.
negativa.Cuando una molécula es apolar, estas cargas no existen.
Se suele usar el término hidrófobo para una sustancia apolar, debido a la similitud de comportamientos: un hidrófobo es aquel o aquello que teme u odia al agua, y las sustancias apolares, no se disuelven en agua, a pesar de ser líquidas (como el aceite) El agua es un disolvente polar, y por tanto, en su seno sólo puede albergar moléculas polares. Esto se basa en que a niveles microscópicos, algo se disuelve en una sustancia cuando aparecen unos puentes moleculares entre las partículas de disolvente y de soluto. Estos puentes (o enlaces moleculares secundarios) aparecen entre las zonas con cargas distintas en ambas sustancias. El agua es una molécula polar (tiene dos zonas con distinta carga, positiva y negativa) y cualquier cosa que se quiera disolver en ella, ha de ser polar, para poder establecerse dicho enlaces.
PUENTES DE HIDRÓGENO
El enlace puente de hidrógeno es una atracción que existe entre un átomo de hidrógeno (carga positiva) con un átomo de O , N o X (halógeno) que posee un par de electrones libres (carga negativa).
Por ejemplo el agua, es una de las substancias que presenta este tipo de enlaces entre sus moléculas. Una molécula de agua se forma entre un átomo de Oxigeno con seis electrones de valencia (sólo comparte dos y le quedan dos pares de electrones libres) y dos hidrógenos con un electrón de valencia cada uno (ambos le ceden su único electrón al oxígeno para que complete el octeto).
La molecula de agua es una molécula polar, por lo que presenta cuatro cargas parciales, de esta manera la fracción positiva (un hidrógeno) genera una atracción con la fracción negativa de otra molécula (el par de electrones libres del oxígeno de otra molécula de agua). Teóricamente una molécula de agua tiene la capacidad de formar 4 puentes de Hidrógeno
El enlace puente de hidrógeno es 20 veces más débil o de menor contenido energético que un enlace normal. Pareciera ser de poca importancia, pero debido a la gran cantidad de moléculas y gran cantidad de enlaces de este tipo que puede contener una sustancia, el enlace puente de hidrógeno tiene una especial importancia.
Si se compara al H2O , con el H2S deberían de ser substancias muy parecidas ya que el oxígeno y el azufre pertenecen al mismo grupo (VIA), tienen propiedades parecidas, la diferencia es que el oxígeno es más electronegativo. El agua es una moléula polar y puede formar puentes de hidrógeno, mientras que el ácido sulfhídrico (H2S)es no polar y no tiene dicha capacidad.
Los puentes de hidrógeno que existe entre las moléculas de H2O , explican el incremento del pF, pEb, densidad, viscosidad, capacidad caloríca, etc (ya que las moléculas se encuentran unidas entre sí), a diferencia H2S , cuyas moléculas no cuentan con la atracción puente de hidrógeno y por lo tanto a temperatura ambiente es un gas. ESTRUCTURA MOLECULAR DEL AGUA.
El agua pura está formada por un átomo de oxígeno y dos átomos de
hidrógeno, por lo tanto tiene un peso molecular de 18 u.m.a y una masa
molar de 18 gramos.
Dadas las diferencias de electronegatividad entre el oxígeno (3.5) y el
hidrógeno (2.1), los electrones compartidos por los átomos que forman el
enlace covalente, están más cerca del oxígeno que del hidrógeno. Este
compartimento desigual de electrones hace que el oxígeno del agua tienda a
ser parcialmente negativo. mientras que el hidrógeno tienda a ser parcialmente
positivo, (se forma un enlace covalente polar).
hidrógeno (2.1), los electrones compartidos por los átomos que forman el
enlace covalente, están más cerca del oxígeno que del hidrógeno. Este
compartimento desigual de electrones hace que el oxígeno del agua tienda a
ser parcialmente negativo. mientras que el hidrógeno tienda a ser parcialmente
positivo, (se forma un enlace covalente polar).

EJEMPLOS DE MOLÉCULAS POLARES Y NO POLARES

FORMACIÓN DE PUENTES DE HIDRÓGENO.
Un puente de hidrógeno es el enlace o la interacción que se
forma cuando un hidrógeno se encuentra entre dos átomos que
son muy electronegativos.
Un puente de hidrógeno es el enlace o la interacción que se
forma cuando un hidrógeno se encuentra entre dos átomos que
son muy electronegativos.
Cada molécula de agua puede interaccionar por puentes de hidrógeno con
otras cuatro moléculas. Las líneas azules discontinuas
muestran los puentes de hidrógeno y las continuas los enlaces covalentes.Propiedades Físicas del Agua:5
1) Estado físico: sólida, liquida y gaseosa.
2) Color: incolora.
3) Sabor: insípida.
4) Olor: inodoro.
5) Densidad: 1 g./c.c. a 4°C.
6) Punto de congelación: 0°C.
7) Punto de ebullición: 100°C.
8) Presión critica: 217,5 atmósferas.
9) Temperatura critica: 374°C.
Propiedades Químicas del Agua:
1) Reacciona con los óxidos ácidos
2) Reacciona con los óxidos básicos
3) Reacciona con los metales
4) Reacciona con los no metales
5) Se une en las sales formando hidratos
EJEMPLO DE PUENTES DE HIDRÓGENO.

Soluciones. Concentración en por ciento y molar.
Soluciones. Concentración en por ciento y molar.
La nomenclatura p/v y v/v , significa si la solución es peso-volumen o volumen-volumen (sólido disuelto en líquido o líquido disuelto en líquido), generalmente son p/v , por ejemplo una solución de NaOH.
Por ejemplo, se disolvieron 10 ml de alcohol y se aforó con agua para completar 100 ml de solución. ¿ Cuál es su concentración en % ?
Algunos ejemplos de soluciones son las soluciones de bases o ácidos para reacciones de titulación, los reactivos inorgánicos para reacciones orgánicas y las soluciones fisiológicas. Para preparar soluciones exactas o reproducibles, es necesario indicar la cantidad de soluto con respecto a la cantidad de solvente o de solución, a dicha relación se le da el nombre de concentración. Porciento (% p/v , % v/v)
La nomenclatura p/v y v/v , significa si la solución es peso-volumen o volumen-volumen (sólido disuelto en líquido o líquido disuelto en líquido), generalmente son p/v , por ejemplo una solución de NaOH.
El porcentaje (%) es una fracción relativa de algún valor multiplicada por 100, para entender esto se usara un ejemplo simple:
"Supongamos que se tienen 20 listones; 8 listones verdes, 9 azules y 3 rojos; para referirnos a los listones rojos diríamos que hay 3 de 20 y expresado en fracción sería (3/20), pero si esa fracción se multiplica por 100, sería (3/20 X 100) , lo que equivale a decir que el 15 % de los listones son rojos" .
En una solución el total es soluto más solvente. Es decir g de soluto + ml de solvente = ml de solución , y si se desea saber cuanto soluto hay con respecto a la solución, la fracción sería g de soluto/ml de solución , y si esa fracción se multiplica por 100, sería el porciento.
% p/v = g soluto X 100 |
ml de solución |
Por ejemplo si se agregan 10g de soluto, para preparar 500 ml de solución se diría 10g en 500 ml, pero expresado en porciento sería.
% p/v = 10 g de soluto X 100 |
500 ml de solución |
% p/v = 2% , se dice que es una "solución al 2 %".
Ejemplo: ¿Cuál es la concentración en % cuando se añaden 130g de NaOH y se completa con agua (o se afora) hasta alcanzar un volumen de solución de 1 litro?.
% p/v = 130 g de NaOH X 100 |
1000 ml de solución |
% p/v = 13 % , se dice que es una "solución de NaOH al 13 %".
La fórmula tiene 3 incógnitas (3 variables) por lo que se puede cuestionar cualquiera de ellas, si se dan las 2 restantes.
Ejemplo: ¿Cuántos g de Na2CO3 se necesitan para preparar 250 ml de una solución al 5%?.
Ejemplo: ¿Cuántos g de Na2CO3 se necesitan para preparar 250 ml de una solución al 5%?.
Despejando de la fórmula:
g de soluto = (ml de solución) X (% p/v) |
100 |
g de Na2CO3 = (250 ml) X (5%) |
100 |
g de Na2CO3 = 12.5 g
Cuando el soluto es líquido entonces la fórmula es:
% v/v = ml de soluto X 100 |
ml de solución |
Por ejemplo, se disolvieron 10 ml de alcohol y se aforó con agua para completar 100 ml de solución. ¿ Cuál es su concentración en % ?
%v/v = 10 ml de soluto X 100 |
100 ml de solución |
% v/v = 10% , se dice que es una "solución de alcohol al 10 %"
Molaridad
La concentración Molar o Molaridad, es el número de moles por litros de solución. , por lo tanto si una solución contiene un mol de NaCl (58.5 g), en un litro de solución, su concentración es 1 Molar.
M = # moles de soluto |
litros de solución |
# moles = g de soluto |
PM |
POR LO TANTO
M = g de soluto/ PM |
litros de solución |
Ejercicio: Cuál es la concentración molar de una solución que se preparó con 12.5 g de NaCl y se aforó hasta acompletar 2 litros de solución. PM de NaCl 0 58.5.
M = 12.5 g/ 58.5 |
2 litros |
M = 0.106 , se dice que es una "solución 0.106 Molar ".
Por ejemplo, ¿ Cuál será la molaridad de una solución que se prepara disolviendo 15 g de CH3COONa y se afora a 250 ml ?. PM del = 82
M = 15 g/ 82 |
0.25 litros |
M = 0.73 , se dice que es una "solución 0.73 Molar ".
Nota : El mol (peso molecular gramo) es la suma de los pesos atómicos de los átomos que constituyen una molécula, esto significa que la condición necesaria para determinar la molaridad de una substancia, es que exista realmente como molécula en solución.
Por ejemplo si disolvemos 36.5 g de HCl , que es un peso fórmula (PF), en un litro de solución, tendremos una concentración 1 Formal. Pero una vez que el gas se disuelve en agua se disocia completamente en iones hidrógeno y en iones cloruro, por lo que no existen moléculas de HCl en disolución, por lo tanto "no podemos" determinar la Molaridad del ácido clorhídrico en la solución.
Muchos autores consideran como sinónimos a la formalidad y la molaridad (numéricamente), independientemente de que las substancias existan o no como moléculas en solución.
Uso Responsable del Agua
Uso Responsable del agua

- Repara las instalaciones defectuosas que originan perdidas o fugas de agua.

El agua es un líquido fundamental para la supervivencia. Sin embargo, muchos ciudadanos no son conscientes de su importancia y se olvidan de racionar su uso. El mundo está formado por un 70% de agua, pero la mayor parte es agua salada no apta para el consumo. El proceso de desalinización sigue siendo muy caro, por lo que nos queda moderar y controlar el gasto de agua. Apenas 0.5% del agua mundial está disponible para el consumo.
Los principales consumidores son los sectores agropecuario e industrial, por eso los países desarrollados tienen políticas y controles ambientales cada vez más estrictos en todos los procesos. Pero desde las casas también podemos ayudar a no malgastar agua. Con los siguientes ejemplos podremos evitar el desperdicio de agua:

- Repara las instalaciones defectuosas que originan perdidas o fugas de agua.
- Cerrar bien el grifo después de usarlo
- No abrir el grifo inútilmente, abrirlo en el momento que entres a la ducha. Mantenerlo cerrado mientras te cepillas los dientes.
- No dejes caer agua si estas realizando otra actividad
- Utilizar la lavadora con la mayor carga máxima de ropa
- No dejar abiertas las mangueras del jardín.
- Lavar el coche con la menor cantidad de agua para no desperdiciarla

Composicion del agua
Electrolisis
La electrólisis del agua es la descomposición de agua (H2O) en gas de oxígeno (O2) e hidrógeno (H2) por medio de una corriente eléctrica a través del agua. Este proceso electrolítico es raramente usado en aplicaciones industriales debido a que el hidrógeno puede ser producido a menor coste por medio de combustibles fósiles.
Una fuente de poder eléctrica es conectada a dos electrodos, o dos platos (típicamente hechos de algún metal inerte como el platino o acero inoxidable), los cuales son puestos en el agua. En una celda propiamente diseñada, el hidrógeno aparecerá en el cátodo (el electrodo negativamente cargado, donde los electrones son bombeados al agua), y oxigeno aparecerá en el ánodo (el electrodo positivamente cargado). La cantidad de hidrógeno generado es el doble que la de oxigeno, y ambas son proporcionales al total de carga eléctrica que fue enviada por el agua. Sin embargo, en varias celdas las reacciones del lado competidor dominan, resultando en diferentes productos.
La electrolisis de agua pura requiere una gran cantidad de energía extra en forma de sobrepotencial para romper varias barreras de activación. Sin esa energía extra la electrólisis de agua pura ocurre muy lentamente si es que logra suceder. Esto es en parte debido a la limitada autoionización del agua. El agua pura tiene una conductividad eléctrica alrededor de una millonésima parte de la del agua de mar. Varias celdas electrolíticaselectrocatalizadores requeridos. La eficacia de la electrólisis aumenta con la adición de un electrolito (como la sal, un ácido o una base) y el uso de electrocatalizadores.
Sintesis
Si por descomposición del agua se obtienen hidrógeno y oxígeno, cabe preguntarse si no podrá lograrse agua por
unión de estos gases. En efecto, se puede hacer eso por varios métodos. Si se obtiene mediante una cuba hidroneumática una mezcla de oxígeno e hidrógeno en la misma relación de volúmenes que se tuvo en el caso de la descomposición, y el tubo así lleno de gases se aproxima a una llama, se producirá una explosión, de la que resultará agua.
unión de estos gases. En efecto, se puede hacer eso por varios métodos. Si se obtiene mediante una cuba hidroneumática una mezcla de oxígeno e hidrógeno en la misma relación de volúmenes que se tuvo en el caso de la descomposición, y el tubo así lleno de gases se aproxima a una llama, se producirá una explosión, de la que resultará agua.
Propiedadades del agua
PUNTOS DE FUSION Y EBULLICION
Calor y Temperatura:
En el lenguaje cotidiano solemos confundir los términos calor y temperatura. Así, cuando hablamos del calor que hace en el verano o lo mal que saben los refrescos calientes, realmente nos referimos a la temperatura, a la mayor o menor temperatura del aire o los refrescos. La temperatura es una magnitud física que nos permite definir el estado de una sustancia, lo mismo que cuando decimos que un coche circula a 90 km/h o que una casa tiene 5 m de alto.
Cuando se ponen en contacto dos sustancias a distinta temperatura, evolucionan de forma que el cuerpo a mayor temperatura la disminuye y el que tenía menor temperatura la aumenta hasta que al final los dos tienen la misma temperatura, igual que al echar un cubito de hielo a un refresco,que el refresco se enfría y el cubito de hielo se calienta y termina convirtiéndose en agua. Decimos que la sustancia a mayor temperatura ha cedido calor a la sustancia que tenía menor temperatura.
Sin embargo, el calor no es algo que esté almacenado en el cuerpo más caliente y que pasa al cuerpo más frío. Tanto uno como otro poseen energía, que depende de la masa del cuerpo, de su temperatura, de su ubicación, etc. y recibe el nombre de energía interna . Cuando esta energía interna pasa de una sustanciadiferencia de temperatura entre ellas la llamamos a otra a causa de la calor. Una catarata es agua que pasa de un sitio a otro porque están a distinta altura, de forma similar el calor es la energía que pasa de un cuerpo a otro porque están a distinta temperatura.
Punto de ebullición:
Si ponemos al fuego un recipiente con agua, como el fuego está a mayor temperatura que el agua, le cede calor y la temperatura del agua va aumentando, lo que podemos comprobar si ponemos un termómetro en el agua. Cuando el agua llega a 100 °C, empieza a hervir,convirtiéndose en vapor de agua, y deja de aumentar su temperatura, pese a que el fuego sigue suministrándole calor: al pasar de agua a vapor de agua todo el calor se usa en cambiar de líquido a gas, sin variar la temperatura.
La temperatura a la que una sustancia cambia de líquido a gas se llama punto de ebullición y es una propiedad característica de cada sustancia, así, el punto de ebullición del agua es de 100 °C, el del alcohol de 78 °C y el hierro hierve a 2750 °C.
Punto de fusión:
Si sacas unos cubitos de hielo del congelador y los colocas en un vaso con un termómetro verás que toman calor del aire de la cocina y aumentan su temperatura. En un principio su temperatura estará cercana a -20 °C (depende del tipo de congelador) y ascenderá rápidamente hasta 0 °C, se empezará a formar agua líquida y la temperatura que permanecerá constante hasta que todo el hielo desaparezca.
Igual que en el punto de ebullición, se produce un cambio de estado, el agua pasa del estado sólido (hielo) al estado líquido (agua) y todo el calor se invierte en ese cambio de estado, no variando la temperatura, que recibe el nombre de punto de fusión. SE trata de una temperaturapunto de fusión del agua es de 0 °C, el alcohol funde a -117 °C y el hierro a 1539 °C.
Densidad
El agua líquida es más densa que el hielo a presión y temperatura estándar. Existe un cambio positivo en el volumen después del congelamiento, lo que ocasiona que el hielo flote. Si el hielo no flotara, la vida acuática en cuerpos de agua como lagos y en los polos terrestres, no existiría pues estos cuerpos de agua se congelarían desde el fondo hacia la superficie, de hecho, lo contrario, la capa de hielo que se forma sobre estos cuerpos de agua, resulta en un aislante térmico.
Calor Latente del Agua
- de fusión: 333,9 kJ/kg (79,9 kcal/kg) a 0 ºC;
- de vaporización: 2253 kJ/kg (539 kcal/kg) a 100 ºC.
Tension superficial. Poder disolvente.
Tension Superficial
En un fluido cada molécula interacciona con las que le rodean. El radio de acción de las fuerzas moleculares es relativamente pequeño, abarca a las moléculas vecinas más cercanas. Vamos a determinar de forma cualitativa, la resultante de las fuerzas de interacción sobre una molécula que se encuentra en
- A, el interior del líquido
- B, en las proximidades de la superficie
- C, en la superficie
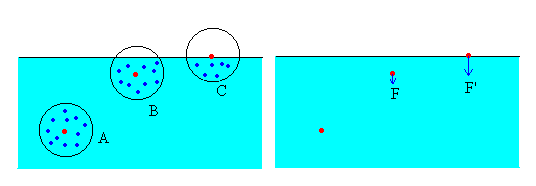
Consideremos una molécula (en color rojo) en el seno de un líquido en equilibrio, alejada de la superficie libre tal como la A. Por simetría, la resultante de todas las fuerzas atractivas procedentes de las moléculas (en color azul) que la rodean, será nula.
En cambio, si la molécula se encuentra en B, por existir en valor medio menos moléculas arriba que abajo, la molécula en cuestión estará sometida a una fuerza resultante dirigida hacia el interior del líquido.
Si la molécula se encuentra en C, la resultante de las fuerzas de interacción es mayor que en el caso B.
La fuerzas de interacción, hacen que las moléculas situadas en las proximidades de la superficie libre de un fluido experimenten una fuerza dirigida hacia el interior del líquido.
Como todo sistema mecánico tiende a adoptar espontáneamente el estado de más baja energía potencial, se comprende que los líquidos tengan tendencia a presentar al exterior la superficie más pequeña posible.
Coeficiente de tensión superficial
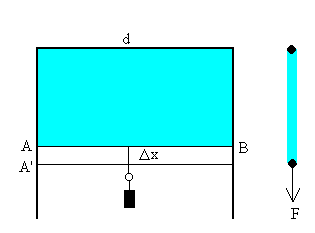 | Se puede determinar la energía superficial debida a la cohesión mediante el dispositivo de la figura. Una lámina de jabón queda adherida a un alambre doblada en doble ángulo recto y a un alambre deslizante AB. Para evitar que la lámina se contraiga por efecto de las fuerzas de cohesión, es necesario aplicar una fuerza F al alambre deslizante. |
La fuerza F es independiente de la longitud x de la lámina. Si desplazamos el alambre deslizante una longitud Dx, las fuerzas exteriores han realizado un trabajo FDx, que se habrá invertido en incrementar la energía interna del sistema. Como la superficie de la lámina cambia en DS=2dDx (el factor 2 se debe a que la lámina tiene dos caras), lo que supone que parte de las moléculas que se encontraban en el interior del líquido se han trasladado a la superficie recién creada, con el consiguiente aumento de energía.
Si llamamos a g la energía por unidad de área, se verificará que
la energía superficial por unidad de área o tensión superficial se mide en J/m2 o en N/m.
La tensión superficial depende de la naturaleza del líquido, del medio que le rodea y de la temperatura. En general, la tensión superficial disminuye con la temperatura, ya que las fuerzas de cohesión disminuyen al aumentar la agitación térmica. La influencia del medio exterior se comprende ya que las moléculas del medio ejercen acciones atractivas sobre las moléculas situadas en la superficie del líquido, contrarrestando las acciones de las moléculas del líquido.
El poder disolvente del agua
La estructura de la molécula de agua la hace capaz de actuar como un disolvente poderoso de muchas sustancias. Si se introduce un cristal de cloruro de sodio en agua, las moléculas de agua rodean a los iones de sodio y cloro, atrayéndolos por sus extremos negativos o positivos, respectivamente.
El movimiento de las moléculas de agua arrastra a los iones que se dispersan por ella, formando una disolución de cloruro de sodio en agua. Ello hace que en la naturaleza exista un enorme número de disoluciones acuosas.

ESTRUCTURA Y PROPIEDADES DE LOS LÍQUIDOS
LÍQUIDOS
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas.
Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad.
En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía).
MODELO CINÉTICO MOLECULAR DE LOS LÍQUIDOS
A lo largo de la historia del pensamiento humano se ha elaborado un modelo a cerca de como está constituida la materia, se conoce con el nombre de modelo cinetico molecular.
Suscribirse a:
Comentarios (Atom)








